日前,國際著名學術期刊Materials horizons在線發(fā)表了公共衛(wèi)生學院宋海云課題組與上海交通大學化學化工學院樊春海課題組共同發(fā)表的論文Reprogramming of Cancer Invasiveness and Macrophage Education via Nanostructured Antagonist of TGF Receptor。該研究利用納米金剛石對TGF 信號通路的干擾降低腫瘤細胞的侵襲性和腫瘤細胞對巨噬細胞的馴化能力,抑制腫瘤轉移。
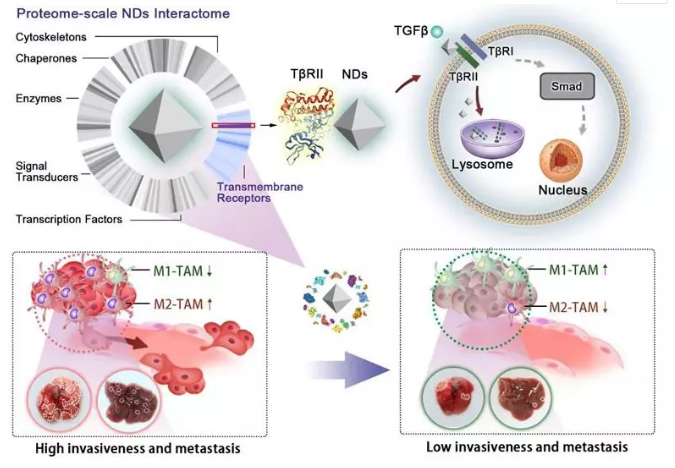
納米結構作為藥物、生物大分子和成像探針的載體,或者光熱信號的接收和轉換者,已經廣泛應用于醫(yī)學研究和疾病治療。近年來,人們發(fā)現(xiàn)一些納米結構在“空載”的狀態(tài)下,即能依靠自身的生物學效應產生一定的療效。納米金剛石具有優(yōu)良的藥物遞送能力和較好的生物相容性,但通常被視為一種不具備生物活性的納米載體。
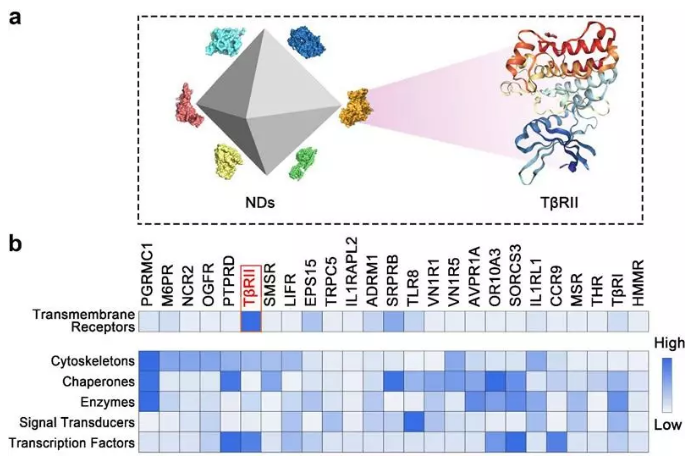
在本項工作中,研究人員首先利用蛋白質組學的方法分析了納米金剛石進入細胞的動態(tài)過程中與之相互作用的蛋白質網絡,發(fā)現(xiàn)在與納米金剛石結合的跨膜受體蛋白中,轉化生長因子 (TGF )的II型受體(T RII)占據(jù)了最高的比例。進一步的研究顯示,這種相互作用干擾了TGF 受體的循環(huán)利用并促進其進入溶酶體降解途徑,從而抑制TGF 引發(fā)的信號轉導。
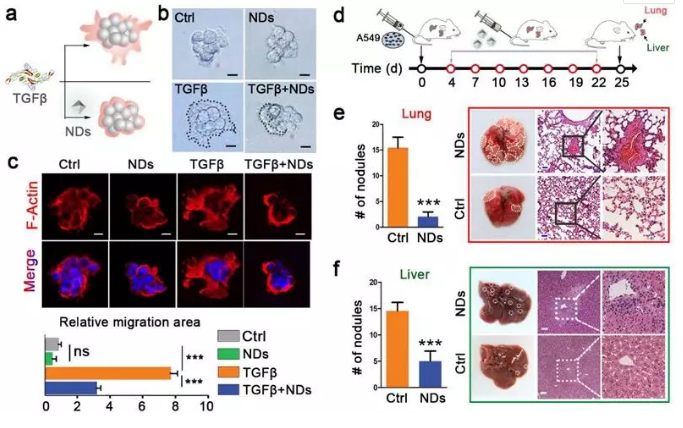
TGF 信號通路的異常激活能夠促進腫瘤轉移和誘導免疫抑制。在TGF 作用下,浸潤到腫瘤組織的巨噬細胞極化成M2型腫瘤相關巨噬細胞(M2-TAM)是腫瘤逃避免疫效應的重要途徑之一。研究人員通過在體外培養(yǎng)的癌細胞、3D培養(yǎng)的腫瘤球狀體和小鼠腫瘤模型中的測試,發(fā)現(xiàn)向腫瘤細胞及其微環(huán)境遞送納米金剛石能有效地抑制腫瘤細胞的遷移能力、侵襲能力和馴化巨噬細胞的能力。因此,納米金剛石不僅可以作為藥物載體,還能主動地參與對細胞功能的調控,從而在疾病治療過程中發(fā)揮更積極的作用。
劉唱、胡興杰和李曉嬌為文章的共同第一作者。該研究工作得到國家自然科學基金委、中國博士后科學基金和上海市教委的資助。


 手機資訊
手機資訊 官方微信
官方微信










 豫公網安備41019702003646號
豫公網安備41019702003646號